 | ||||
| Antoine Lavoisier 1743/1794 | considerado el padre de la Quimica Moderna |
La ubicuidad de la química en las ciencias naturales hace que sea considerada una de las ciencias basicas La química es de gran importancia en muchos campos del conocimiento, como la ciencia de materiales, la biología, la farmacia, la medicina, la geologia, la ingenieria y la astronomia, entre otros.
Los procesos naturales estudiados por la química involucran partículas fundamentales, partículas compuestas (núcleos atómicos, átomos y moléculas) o estructuras microscópicas como cristales y superficies.
Desde el punto de vista microscópico, las partículas involucradas en una reacción química pueden considerarse un sistema cerrado que intercambia energía con su entorno. En procesos exotermico, el sistema libera energía a su entorno, mientras que un proceso endotermico solamente puede ocurrir cuando el entorno aporta energía al sistema que reacciona. En la mayor parte de las reacciones químicas hay flujo de energía entre el sistema y su campo de influencia, por lo cual puede extenderse la definición de reacción química e involucrar la (calor) como un reactivo o producto.
Aunque hay una gran variedad de ramas de la química, las principales divisiones son:
- bioquimica
- fisicoquimica
- quimica analitica
- quimica inorganita
- química física
 Physical chemistry
Physical chemistry - física química
 Chemical physics
Chemical physics
La gran importancia de los sistemas biológicos hace que en la actualidad gran parte del trabajo en química sea de naturaleza bioquímica. Entre los problemas más interesantes se encuentran, por ejemplo, el estudio del plegamiento de proteinas y la relación entre secuencia, estructura y función de proteinas.
Si hay una particula importante y representativa en la química, es el electron. Uno de los mayores logros de la química es haber llegado al entendimiento de la relación entre reactividad química y distribución electrónica de átomos, moléculas o sólidos. Los químicos han tomado los principios de la mecanica cuantica y sus soluciones fundamentales para sistemas de pocos electrones y han hecho aproximaciones matemáticas para sistemas más complejos. La idea de orbital atómico y molecular es una forma sistemática en la cual la formación de enlaces es comprensible y es la sofisticación de los modelos iniciales de puntos de Lewis. La naturaleza cuántica del electrón hace que la formación de enlaces sea entendible físicamente y no se recurra a creencias como las que los químicos utilizaron antes de la aparición de la mecánica cuántica. Aun así, se obtuvo gran entendimiento a partir de la idea de puntos de Lewis.
Historia
Las primeras experiencias del ser humano como químico se dieron con la utilización del fuego en la transformación de la materia, la obtención de hierro a partir del mineral y de vidrio a partir de arena son claros ejemplos. Poco a poco la especie humana se dio cuenta de que otras sustancias también tienen este poder de transformación. Se dedicó un gran empeño en buscar una sustancia que transformara un metal en oro, lo que llevó a la creación de la alquimia. La acumulación de experiencias alquímicas jugó un papel vital en el futuro establecimiento de la química.La química es una ciencia empírica, ya que estudia las cosas por medio del método científico, es decir, por medio de la observación, la cuantificación y, sobre todo, la experimentación. En su sentido más amplio, la química estudia las diversas sustancias que existen en nuestro planeta así como las reacciones que las transforman en otras sustancias. Por otra parte, la química estudia la estructura de las sustancias a su nivel molecular. Y por último, pero no menos importante, sus propiedades.
Subdisciplinas de la química
La química cubre un campo de estudios bastante amplio, por lo que en la práctica se estudia de cada tema de manera particular. Las seis principales y más estudiadas ramas de la química son- quimica ignorganica: síntesis y estudio de las propiedades eléctricas, magnéticas y ópticas de los compuestos formados por átomos que no sean de carbono (aunque con algunas excepciones). Trata especialmente los nuevos compuestos con metales de transición, los ácidos y las bases, entre otros compuestos.
- quimica organica: Síntesis y estudio de los compuestos que se basan en cadenas de carbono.
- bioquimica: estudia las reacciones químicas en los seres vivos, estudia el organismo y los seres vivos.
- quimica fisica: estudia los fundamentos y bases físicas de los sistemas y procesos químicos. En particular, son de interés para el químico físico los aspectos energéticos y dinámicos de tales sistemas y procesos. Entre sus áreas de estudio más importantes se incluyen la termodinamica quimica, la cinetica quimica, le electroquimica, la mecanica estadistica y la espectroscopio. Usualmente se la asocia también con la quimica cuantica y la quimica teorica.
- Quimica industrial: Estudia los métodos de producción de reactivos químicos en cantidades elevadas, de la manera económicamente más beneficiosa. En la actualidad también intenta aunar sus intereses iniciales, con un bajo daño al medio ambiente.
- quimica analitica: estudia los métodos de detección y cuantificación de una sustancia en una muestra. Se subdivide en Cuantitativa y Cualitativa.
Además existen múltiples subdisciplinas que, por ser demasiado específicas o bien multidisciplinares, se estudian individualmente:
- astroquimica
- electroquimica
- fotoquimica
- magnetoquimica
- nanoquimica (relacionada con la nanotecnologia)
- petroquimica
- geoquimica: estudia todas las transformaciones de los minerales existentes en la tierra.
- quimica computacional
- quimica cuantica
- quimica macromolecular: estudia la preparación, caracterización, propiedades y aplicaciones de las macromoléculas o polímeros;
- quimica medioambiental: estudia la influencia de todos los componentes químicos que hay en la tierra, tanto en su forma natural como antropogenica;
- quimica nuclear
- quimica organometalica
- quimica supremolecular
- quimica teorica
Los aportes de célebres autores
Hace aproximadamente 455 años sólo se conocían doce elementos. A medida que fueron descubriendo más elementos, los científicos se dieron cuenta de que todos guardaban un orden preciso. Cuando los colocaron en una tabla ordenados en filas y columnas, vieron que los elementos de una misma columna tenían propiedades similares. Pero también aparecían espacios vacíos en la tabla para los elementos aún desconocidos. Estos espacios huecos llevaron al científico ruso pronosticar la existencia del germanio, de número atómico 32, así como su color, su peso, su densidad y su punto de fusión. Su “predicción sobre otros elementos como el galio y el escandio también resultó muy atinada”, señala la obra Chemistry, libro de texto de química editado en 1995.
Véase también: categoria quimicos
Campo de trabajo: el átomo
El origen de la teoria atomica se remonta a la escuela filofica de los atomistas, en la Grecia antigua. Los fundamentos empíricos de la teoría atómica, de acuerdo con el metodo cientifico, se debe a un conjunto de trabajos hechos por, louis proins, John Dalton y Amadeo Amogadro entre muchos otros, hacia principios del siglo XIX.Los Atomos son la fracción más pequeña de materia estudiados por la química, están constituidos por diferentes partículas, cargadas eléctricamente, los electrones, de carga negativa; losprotones, de carga positiva; los neutrones, que, como su nombre indica, son neutros (sin carga); todos ellos aportan masa para contribuir al peso.
Conceptos fundamentales
Partículas
Los atomos son las partes más pequeñas de un elemento (como el carbono, el hierro o el oxigeno). Todos los átomos de un mismo elemento tienen la misma estructura electrónica (responsable ésta de la mayor parte de las características químicas), y pueden diferir en la cantidad de neutrones sustancia(isotopos). Las moleculas son las partes más pequeñas de unasustancia (como el azucar), y se componen de átomos enlazados entre sí. Si tienen carga electrica, tanto átomos como moléculas se llaman iones:cationes si son positivos,aniones si son negativos.El mol se usa como contador de unidades, como la docena (12) o el millar (1000), y equivale a
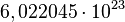 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con elnumero de abogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con elnumero de abogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:1 mol de Glucosa equivale a
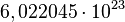 moléculas de glucosa. 1 mol de uraneo equivale a
moléculas de glucosa. 1 mol de uraneo equivale a 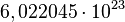 átomos de uranio.
átomos de uranio.Dentro de los átomos pueden existir un nucleo atomico y uno o más electroenes. Los electrones son muy importantes para las propiedades y las reacciones químicas. Dentro del núcleo se encuentran los neutrones y los protones. Los electrones se encuentran alrededor del núcleo. También se dice que el átomo es la unidad básica de la materia con características propias. Está formado por un núcleo, donde se encuentran protones.
De los átomos a las moléculas
Los enlases son las uniones entre átomos para formar moléculas. Siempre que existe una molécula es porque ésta es más estable que los átomos que la forman por separado. A la diferencia de energia entre estos dos estados se le denomina energia de enlase.Generalmente los átomos se combinan en proporciones fijas para generar moléculas. Por ejemplo, dos átomos de hidregeno se combinan con uno de oxígeno para dar una molécula de agua. Esta proporción fija se conoce como estequeometria.
Orbitales
Orbital Atomico y Orbital Molecular
Para una descripción y comprensión detalladas de las reacciones
químicas y de las propiedades físicas de las diferentes sustancias, es
muy útil su descripción a través deorbitales, con ayuda de la quimica cuantica.Un orbital atomico es una funcion matematico que describe la disposición de uno o dos electrones en un átomo. Un orbital molecular es el análogo en las moléculas.
En lateoria del orbital molecular la formación delenlase covalente se debe a una combinación matemática de orbitales atómicos (funciones de onda) que forman orbitales moleculares, llamados así por que pertenecen a toda la molécula y no a un átomo individual. Así como un orbital atómico (sea híbrido o no) describe una región del espacio que rodea a un átomo donde es probable que se encuentre un electrón, un orbital molecular describe también una región del espacio en una molécula donde es más factible que se hallen los electrones.
Al igual que un orbital atómico, un orbital molecular tiene un tamaño, una forma y una energía específicos. Por ejemplo, en la molécula de hidrógeno molecular se combinan dos orbitales atómicos, ocupado cada uno por un electrón. Hay dos formas en que puede presentarse la combinación de orbitales: aditiva y substractiva. La combinación aditiva produce la formación de un orbital molecular que tiene menor energía y que presenta una forma casi ovalada, mientras que la combinación substractiva conduce a la formación de un orbital molecular con mayor energía y que genera un nodo entre los núcleos.
De los orbitales a las sustancias
Los orbitales son funciones matemáticas para describir procesos físicos: un orbital únicamente existe en el sentido matemático, como pueden existir una suma, una parabola o una raiz cuadrada. Los átomos y las moléculas son también idealizaciones y simplificaciones: un átomo y una molécula sólo existen en el vacio, y en sentido estricto una molécula sólo se descompone en átomos si se rompen todos sus enlaces.En el "mundo real" únicamente existen los materiales y las sustancias. Si se confunden los objetos reales con los modelos teóricos que se usan para describirlos, es fácil caer en falacias logicas.
Disoluciones
En agua, y en otros disolventes (como la acetona o el alcohol), es posible disolver sustancias, de forma que quedan disgregadas en las moléculas o en los iones que las componen (las disoluciones son transparentes). Cuando se supera cierto límite, llamado solubilidad, la sustancia ya no se disuelve, y queda, bien como precipitado en el fondo del recipiente, bien como suspension, flotando en pequeñas partículas (las suspensiones son opacas o traslúcidas).Se denomina concentracion a la medida de la cantidad de soluto por unidad de cantidad de disolvente.
Medida de la concentración
La concentración de una disolución se puede expresar de diferentes formas, en función de la unidad empleada para determinar las cantidades de soluto y disolvente. Las más usuales son:Acidez
El pH es una escala logaritmica para describir la acidez de una disolucion acuosa. Los acidos, como por ejemplo el zumo de limon y el vinagre, tienen un pH bajo (inferior a 7). Las bases, como la sosa o el bicarbonato de sodio, tienen un pH alto (superior a 7).El pH se calcula mediante la siguiente ecuación:
 es la actividad deiones hidrogenos en la solución, la que en soluciones diluidas es numéricamente igual a la molaridad de iones hidrogeno
es la actividad deiones hidrogenos en la solución, la que en soluciones diluidas es numéricamente igual a la molaridad de iones hidrogeno ![[H^+]\,](http://upload.wikimedia.org/math/1/e/f/1ef3bcce90c20f8119eebc5d3fa164a5.png) que cede el ácido a la solución.
que cede el ácido a la solución.- una solución neutral (agua ultra pura) tiene un pH de 7, lo que implica una concentración de iones hidrógeno de 10-7 M;
- una solución ácida (por ejemplo, de acido sulfurico)tiene un pH < 7, es decir, la concentración de iones hidrógeno es mayor que 10-7 M;
- una solución básica (por ejemplo, dehidroxido de potacio) tiene un pH > 7, o sea que la concentración de iones hidrógeno es menor que 10-7 M.
Formulación y nomenclatura
La IUPAC, un organismo internacional, mantiene unas reglas para laformulacion y nomenclatura quimica. De esta forma, es posible referirse a los compuestos químicos de forma sistemática y sin equívocos.Mediante el uso de formulas quimicas es posible también expresar de forma sistemática las reacciones químicas, en forma de ecuacion quimica.
Por ejemplo:

![pH= -\log a_{H^+} \approx -\log [H^+]\,](http://upload.wikimedia.org/math/a/c/4/ac4dad8f18c628b37c90eccb2bb4b8cb.png)
